目次
●目的:マウス心筋組織から総タンパク質を抽出する。
●処理条件
| 使用機種 | UCD-250 型 |
|---|---|
| サンプル | マウス C57BL 心筋組織 |
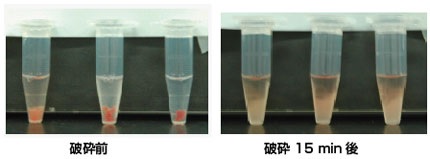
| サンプル調製法 | 湿重量20mg の心筋組織を3mm角に切断し、IP buffer 500μLに加えてサンプルとした。 |
| 使用チューブ | 1.5mL チューブ(Eppendorf 社製) |
| 超音波処理条件 | 出力 310W, 30sec ON/30sec OFF/Total 15min, 冷水循環器(#CP-80R)で水温は 4℃に維持。 |
| タンパク質濃度定量法 | 超音波処理後のサンプルを 2,000xg, 3min, 4℃ で遠心して上清を回収した。 BCA protein assay kit を用いて上清のタンパク質定量を行った。 |
●結果:処理時間に応じて心筋組織からタンパク質を抽出することができた。
| 処理時間 | 5min | 15min |
|---|---|---|
| n数 | 6 | 6 |
| 平均タンパク質濃度(mg/mL) | 2.39 | 5.86 |
| 標準偏差 | 0.31 | 0.33 |
●目的:HeLa 細胞から総タンパク質を抽出する。
●処理条件
| 使用機種 | UCW-310 型 |
|---|---|
| サンプル | HeLa 細胞(1x109cells/mL)・250μL |
| n数 | 24(左右のギヤ版に12本ずつセット) |
| 使用チューブ | 1.5mLチューブ(Eppendorf 社製) |
| 超音波処理条件 | 出力 310W, 30sec ON/30sec OFF/Total 10min, 冷水循環器(#CP-80R)で水温は 4℃に維持。 |
| タンパク質濃度定量法 | 上記実験と同様。 |
●結果:全てのサンプルからほぼ均一にタンパク質を抽出することができた。
| 1回目 | 2回目 | |
|---|---|---|
| 平均タンパク質濃度 (mg/mL) | 3.26 | 3.36 |
| 標準偏差 | 0.25 | 0.2 |
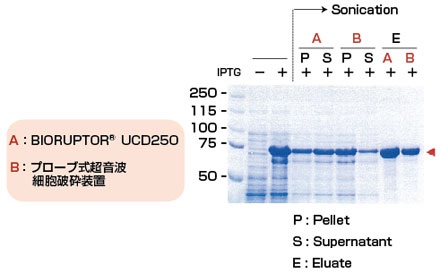
| 機種 | UCD-250型 | |
|---|---|---|
| 実験方法 | IPTG誘導を行った大腸菌ペレットに12mLのバッファーを加え超音波処理する。 その後、GST融合タンパク質を Glutathione Sepharose®で精製する。 |
|
| 超音波処理条件 | 250W, 20sec ON/20sec OFF/Total 8min |
200W, 1min ON/1min OFF/Total 8min |
| 結果 | バイオラプターはプローブタイプに比べて効率的に大腸菌を破砕することができた。 | |
SEPHAROSE®はGE Healthcare社の登録商標です。
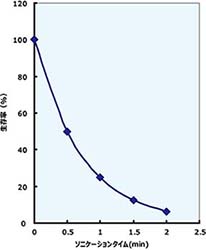
| サンプル | 1mL、2~3x109cells/mL |
|---|---|
| 容器 | 10mL チューブ |
| 処理条件 | (1)200W, 30sec ON/30sec OFF/Total 4min |
| (2)200W, 30sec ON/30sec OFF/Total 8min | |
| 結果 | (1)95%以上破砕 |
| (2)100%破砕 |
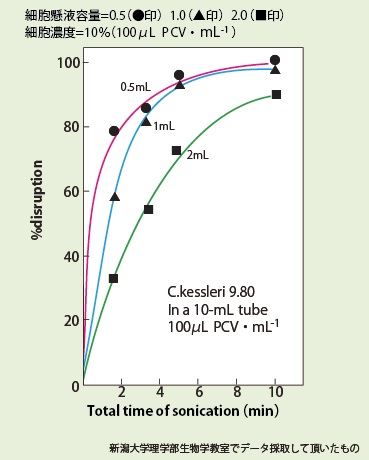
10mL容器によるクロレラ細胞
(Chlorella kessleri 9.80(white mutant))の破砕に及ぼす試料容積の影響
超音波出力200W
| サンプル | 容器 | サンプル量および濃度 | 処理時間 | 破砕・溶解状況 |
|---|---|---|---|---|
| 1. マウスの心臓 (1mm角に切ったもの) |
(1)10mlスピッツ | (1)0.5ml | (1)10sec破砕x10sec休止x45回(15min) | (1)ほぼ100%破砕 |
| 2.乳酸菌 (Lactobacillus, Lactobacillus acidophilus group菌) |
(1)10mlスピッツ | (1)0.7ml 濃度 1010~1011/ml |
(1) 20sec破砕x20sec休止15回(10min) | |
| 3.培養細胞 (Chinese hamster lung fibroblast) |
(1)1.5mlチューブ | (1)0.2~0.3ml 細胞浮遊液 (in PBS pH7.4) |
(1)10sec破砕x20sec休止x25回(12.5min) | |
| 4.脂溶性酵素基質のミセル化 | (1)1.5mlチューブ | (1)0.2~0.3ml | (1)10sec破砕x20sec休止x25回(12.5min) | |
| 5.アデノウィルス培養細胞 (293細胞) |
(1)50mlスピッツ (ファルコン社 コーニング社住友社製等) |
(1)15ml | (1)30sec破砕x30sec休止x4回(4min) | |
| 6.MRSA (Staphylococcus aureus)の破砕 |
(1)10mlスピッツ | (1)200μl濃度一昼夜培養後その1/200容量をとり、37℃でO.D600=2.7まで培養し集菌洗浄後50mM HCL(pH7.5), 5mM EDTAで1/5にサスペンドしたもの | (1)30sec破砕x30sec休止x40回(40min) | (1)生菌率1% Nite:50μl (1.5mlチューブ)では上記条件で生菌率は60% |
| 7.大腸菌 | 1) (1)50mlスピッツ (標準タイプ) (2)50mlファルコンチューブ |
(1)20ml (2)15ml サンプル濃度 上記両ケース共500mlで O.D1.1-1.2で集菌しバッファーに調合し 25-30mlのサンプルを得る |
(1)20sec破砕x20sec休止x6回(4min) (2)20sec破砕x20sec休止x12回(8min) |
両条件でほぼ同程度(約90%)の破砕結果が得られた。 |
| 8.大腸菌 | 2) (1)10mlスピッツ (2)10mlスピッツ |
(1)1ml (2)1ml (1)濃度 2-3x109個/ml (2)濃度 107-108個/ml |
(1)30sec破砕x30sec休止x4回(4min) (1)30sec破砕x30sec休止x8回(8min) (2)30sec破砕x30sec休止x4回(4min) |
(1)95%以上破砕 (1)100%破砕 (2)100%破砕 |
| 9.大腸菌 (DH5α/pT7 Blue-xys Bcells) |
1) (1)10mlスピッツ (2)10mlスピッツ (3)10mlスピッツ |
(1)0.5ml (2)1ml (3)2ml (1)(2)(3)濃度は同一3x109個/ml |
(1)30sec破砕x30sec休止x5回(5min)、30sec破砕x30sec休止x10回(10min) (2)30sec破砕x30sec休止x5回(5min)、30sec破砕x30sec休止x10回(10min) (3)30sec破砕x30sec休止x5回(5min)、30sec破砕x30sec休止x10回(10min) |
(1)95%以上破砕、100%破砕 (2)約75%破砕、約90%破砕 (3)約50%破砕、約75%破砕 |
| 10.大腸菌 (DH5α/pT 7Blue-xys Bcells) |
2) (1)1.5mlチューブ (TPX製) (2)1.5mlチューブ (TPX製) |
(1)300μl (2)250μl (1)濃度 3x109個/ml (2)濃度 3x109個/ml |
(1)30sec破砕x30sec休止x5回(5min)、30sec破砕x30sec休止x10回(10min) (2)30sec破砕x30sec休止x5回(5min、30sec破砕x30sec休止x10回(10min) |
(1)90%以上破砕、95%以上破砕 (2)約60%破砕、約85%破砕 |
| 11.クロレラ Chlorella kessleri 211-11h (wild type, green), C.kessleri 9.8 (white mutant) |
1) (1)1.5mlチューブ |
(1)100μl (1)濃度 100μl PCV/ml |
(1)30sec破砕x30sec休止x30回(30min) | (1)95%以上破砕 |
| 12.クロレラ Chlorella kessleri 211-11h (wild type, green), C.kessleri 9.8 (white mutant) |
2) (1)10mlスピッツ (2)10mlスピッツ (3)10mlスピッツ |
(1)0.5ml (2)1ml (3)2ml (1)(2)(3)濃度は同一 100μl PCV/ml |
(1)30sec破砕x30sec休止x1回(1min)、 30sec破砕x30sec休止x3回(3min) (2)30sec破砕x30sec休止x1回(1min)、 30sec破砕x30sec休止x3回(3min) (3)30sec破砕x30sec休止x1回(1min)、 30sec破砕x30sec休止x3回(3min) |
(1)80%破砕、95%破砕 (2)60%破砕、92%破砕 (3)30%破砕、70%破砕 |
| 13.クロレラ Chlorella kessleri 211-11h (wild type, green), C.kessleri 9.8 (white mutant) |
3) (1)50mlスピッツ (2)50mlスピッツ |
(1)10ml (2)20ml (1)(2)濃度は同一100μl PCV/ml |
(1)30sec破砕x30sec休止x10回(10min) (2)30sec破砕x30sec休止x10回(10min) |
(1)90%破砕 (2)90%破砕 |
| 14.DNA(マウス genomic DNA)の切断 | 1) (1)1.5mlチューブ (6本懸け) |
(1)50μl 濃度 不明 |
(1)30sec破砕x30sec休止x3回(切断サイズにより調整) (3min) | (1)1kbpを中心に10kbpから100bpの範囲でブロードに切断 |
| 15.DNA(マウス genomic DNA)の切断 | 2) (1)0.5mlチューブ (12本懸け) |
(1)20μl 濃度 不明 |
(1)30sec破砕x30sec休止x3回(切断サイズにより調整)(3min) | (1)1kbpを中心に10kbpから100bpの範囲でブロードに切断 |
| 16.RNAの抽出(RNase-richな抗酸球から) 細胞工学 Vol20 No5 2001 p752参照 |
(1)10ml スピッツ | (1)1ml 濃度 1x106個(抗酸球はD16 negative selectionで100%純度に分離後サイトカイン添加培地で6時間培養し軽く遠心してペレットにしTRI Reagent 1mlを加えてすばやくVortexのHiスピードで15秒間かけ全体を均一化しBioruptorにかける) |
(1)@130W、15sec破砕x15sec休止x2回(1min) | |
| 17.試薬の溶解(コルチゾールデキサメサゾン等難水溶性の試薬)。コルチゾールの水への溶解 | (1)15mlチューブ | (1)12.5mlにHydrocortisolを0.4mg加えて溶解(10-4mol) | (1)@200W 6sec破砕x6sec休止x12回(2.4min) | (1)溶解し変性もなかった。 |

